📃 Bula do Produto
Apresentação:
Tópicos da Bula
Identificação do medicamentoComposiçãoPara que este medicamento é indicado?Como este medicamento funciona?Quando não devo usar este medicamento?O que devo saber antes de usar este medicamento?Onde, como e por quanto tempo posso guardar este medicamento?Como devo usar este medicamento?O que devo fazer quando eu me esquecer de usar este medicamento?Quais os males que este medicamento pode me causar?O que fazer se alguém usar uma quantidade maior do que a indicada deste medicamento?Dizeres legaisIDENTIFICAÇÃO DO MEDICAMENTO
Restiva®
buprenorfina
Adesivo transdérmico 5 mg, 10 mg e 20 mg
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Adesivo transdérmico
Restiva® 5 mg: embalagem com 2 ou 4 adesivos transdérmicos
Restiva® 10 mg: embalagem com 2 ou 4 adesivos transdérmicos
Restiva® 20 mg: embalagem com 2 ou 4 adesivos transdérmicos
USO TRANSDÉRMICO
USO ADULTO
COMPOSIÇÃO
Cada adesivo transdérmico de Restiva® 5 mg contém:
| buprenorfina (libera 5 microgramas/h por um período de 7 dias) | 5 mg |
| excipiente q.s.p. | 1 comprimido |
Excipientes: ácido levulínico, oleil oleato, povidona, Duro-Tak 387-2051 (poliacrilato sem ligação cruzada), Duro-Tak 387-2054 (poliacrilato com ligação cruzada), tereftalato de polietileno. A área contendo a substância ativa é de 6,25 cm2.
Cada adesivo transdérmico de Restiva® 10 mg contém:
| buprenorfina (libera 10 microgramas/h por um período de 7 dias) | 10 mg |
| excipiente q.s.p. | 1 comprimido |
Excipientes: ácido levulínico, oleil oleato, povidona, Duro-Tak 387-2051 (poliacrilato sem ligação cruzada), Duro-Tak 387-2054 (poliacrilato com ligação cruzada), tereftalato de polietileno. A área contendo a substância ativa é de 12,5 cm2.
Cada adesivo transdérmico de Restiva® 20 mg contém:
| buprenorfina (libera 20 microgramas/h por um período de 7 dias) | 20 mg |
| excipiente q.s.p. | 1 comprimido |
Excipientes: ácido levulínico, oleil oleato, povidona, Duro-Tak 387-2051 (poliacrilato sem ligação cruzada), Duro-Tak 387-2054 (poliacrilato com ligação cruzada), tereftalato de polietileno. A área contendo a substância ativa é de 25 cm2.
PARA QUE ESTE MEDICAMENTO É INDICADO?
Restiva® é indicado para o tratamento de dor moderada à forte intensidade (quando é necessário terapia contínua com opioide para obter um controle adequado da dor).
COMO ESTE MEDICAMENTO FUNCIONA?
Os adesivos Restiva® contêm como princípio ativo a buprenorfina que pertence a um grupo de medicamentos chamados analgésicos opioides.
A buprenorfina é continuamente absorvida através da pele em contato com o adesivo transdérmico, atinge a corrente sanguínea e bloqueia as mensagens de dor que são enviadas para o cérebro. O efeito analgésico total da dose inicial ocorre em 72 horas (3 dias), momento a partir do qual o médico poderá alterar a dose.
QUANDO NÃO DEVO USAR ESTE MEDICAMENTO?
Restiva® é contraindicado a pacientes com hipersensibilidade (alergia) à buprenorfina ou a qualquer componente da fórmula.
Restiva® é contraindicado a pacientes com função respiratória gravemente comprometida ou a pacientes que estejam utilizando antidepressivos inibidores da monoaminoxidase (IMAOs), devendo esperar no mínimo 14 dias para iniciar tratamento com buprenorfina.
Restiva® não deve ser utilizado em pacientes com miastenia gravis (uma doença crônica autoimune, caracterizada por déficit motor e fadiga muscular) e delirium tremens (síndrome de abstinência, caracterizada por alucinações e tremedeira).
O QUE DEVO SABER ANTES DE USAR ESTE MEDICAMENTO?
ADVERTÊNCIAS E PRECAUÇÕES
Febre
Doença febril grave pode aumentar a taxa de absorção de buprenorfina.
Lesões cranianas
Restiva® deve ser usado com particular precaução em pacientes com lesão cerebral, lesões intracranianas ou aumento na pressão intracraniana, ou nível reduzido de consciência de origem indeterminada.
Convulsões
A buprenorfina pode diminuir o limiar para convulsão em pacientes com histórico de distúrbios convulsivos.
Depressão respiratória
Deve-se ter especial cautela quando Restiva® for prescrito para pacientes que sabidamente têm, ou suspeita-se que tenham, problemas com abuso de drogas ou álcool ou doença mental séria, uma vez que há relatos de ocorrência de depressão respiratória devido ao uso concomitante de buprenorfina via intravenosa com álcool e benzodiazepínicos.
Intervalo QT
Deve-se ter cautela ao prescrever Restiva® para pacientes com prolongamento congênito de intervalo QT e para pacientes tomando medicações antiarrítmicas de Classe 1A (por exemplo, quinidina, procainamida) ou de Classe III (por exemplo, amiodarona, sotalol) ou qualquer outra medicação que prolongue o intervalo QT.
Outras condições
Restiva® deve ser usado com precaução em pacientes com hipotensão (pressão arterial baixa), hipovolemia e choque (volume sanguíneo reduzido), doença do trato biliar, pancreatite, distúrbios inflamatórios intestinais, hipertrofia prostática, insuficiência adrenocortical.
Restiva® deve ser usado com precaução em pacientes com comprometimento hepático grave (vide “6. COMO DEVO USAR ESTE MEDICAMENTO?”)
Restiva® deve ser usado com precaução após cirurgia abdominal, já que os opioides são conhecidos por comprometer a motilidade intestinal.
Assim como recomendado para todos os opioides, uma redução na dosagem pode ser aconselhável para pacientes com hipotireoidismo.
Restiva® não é recomendado para analgesia no período pós-operatório imediato ou em outras situações caracterizadas por necessidade de analgesia rapidamente variante.
ATENÇÃO: PODE CAUSAR DEPENDÊNCIA FÍSICA OU PSÍQUICA
Dependência de drogas
A buprenorfina produz efeitos semelhantes aos da morfina, incluindo euforia e dependência física, porém a magnitude destes efeitos é menor quando comparado aos efeitos observados com doses semelhantes de agonistas puros. A administração de buprenorfina a pessoas que são fisicamente dependentes de opioides enquadrados como agonistas puros pode levar à síndrome de abstinência, dependendo do nível de dependência física, do tempo e da dose de buprenorfina.
O uso crônico de buprenorfina pode resultar no desenvolvimento de dependência física. A síndrome de abstinência (síndrome de retirada), quando ocorre, geralmente é leve, começa após 2 dias e pode durar até 2 semanas. Os sintomas da síndrome de abstinência incluem agitação, ansiedade, nervosismo, insônia, hipercinesia (excesso de movimentação de um órgão ou região do corpo), tremor e distúrbios gastrointestinais.
Efeitos na habilidade de dirigir veículos e operar máquinas
A buprenorfina pode prejudicar a habilidade de dirigir veículos e operar máquinas.
Durante o tratamento, e 24 horas após a retirada do adesivo, o paciente não deve dirigir veículos ou operar máquinas, pois sua habilidade e atenção podem estar prejudicadas.
Carcinogenicidade, mutagenicidade e comprometimento da fertilidade
Testes indicam que a buprenorfina não é genotóxica, ou seja, não causa danos ao material genético do organismo.
Em estudos realizados em ratos e camundongos não houve evidência de qualquer potencial carcinogênico relevante para os seres humanos.
Estudos para avaliar toxicidade reprodutiva da buprenorfina em ratos não demonstraram comprometimento na fertilidade.
Uso na gravidez
Restiva® deve ser usado durante a gravidez apenas se os benefícios justificarem o potencial risco para o feto.
Demonstrou-se que a buprenorfina atravessa a placenta em humanos, sendo detectada no sangue, urina e mecônio de recém-nascidos e também no leite materno em baixas concentrações.
A administração de analgésicos opioides às mães, incluindo buprenorfina, podem causar depressão respiratória no bebê recém-nascido.
O uso prolongado de buprenorfina durante a gravidez pode resultar em síndrome de retirada nos bebês recém-nascidos.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Uso durante a lactação
Uma vez que a buprenorfina passa para o leite da mãe, Restiva® não deve ser usado por mulheres que estejam amamentando.
Trabalho de parto
Restiva® não é recomendado para uso em mulheres imediatamente antes ou durante o trabalho de parto e parto, uma vez que opioides, em geral, podem causar depressão respiratória em recém-nascidos.
Testes laboratoriais
Foram observados níveis aumentados de aminotransferase (enzimas do fígado) e diminuição de peso com a utilização de buprenorfina.
Este medicamento pode causar doping.
Interações medicamentosas
Restiva® pode interagir com os seguintes medicamentos:
- Medicamentos utilizados para tratar depressão pertencentes ao grupo dos IMAOs. Tais medicamentos devem ser descontinuados 14 dias antes do início de tratamento com Restiva®.
- Outros medicamentos depressores de Sistema Nervoso Central ou outros medicamentos que possam causar depressão respiratória, hipotensão (diminuição da pressão arterial), sedação profunda ou que potencialmente resultem em coma. Tais agentes incluem sedativos ou hipnóticos, anestésicos gerais, outros analgésicos opioides, fenotiazinas, antieméticos de ação central, benzodiazepinas e álcool.
- Anestésicos gerais (por exemplo, halotano) e outros medicamentos que causem uma diminuição do fluxo de sangue pelo fígado podem levar a uma queda na taxa de eliminação da buprenorfina.
- Medicamentos inibidores da CYP3A4 (uma enzima do fígado).
- Indutores enzimáticos (por exemplo, fenobarbitona, carbamazepina, fenitoína e rifampicina).
- Medicamentos utilizados para “afinar” o sangue, por exemplo, varfarina.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento. Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
ONDE, COMO E POR QUANTO TEMPO POSSO GUARDAR ESTE MEDICAMENTO?
Cuidados de conservação
Restiva® deve ser conservado em temperatura ambiente (entre 15º e 30ºC). Não deve ser armazenado sob refrigeração (2ºC a 8ºC).
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características do medicamento
Os adesivos Restiva® são retangulares ou quadrados com cantos arredondados e possuem coloração bege a amarelado. Cada adesivo de Restiva® possui o nome comercial e a concentração impressos em tinta azul.
Cada concentração tem um tamanho diferente. Quanto maior a concentração, maior o tamanho do adesivo.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
COMO DEVO USAR ESTE MEDICAMENTO?
Analgésicos opioides, como Restiva®, podem ser usados para tratar a dor por muitos anos e, na maioria dos casos, não ocorre vício. Entretanto, com o passar do tempo, seu corpo pode se acostumar com o uso de Restiva® de modo que, se você parar de usá-lo repentinamente, pode apresentar alguns sintomas de abstinência. É importante discutir essa questão com seu médico.
Como utilizar o adesivo
Restiva® está disponível em três concentrações diferentes. Seu médico decidirá qual adesivo, ou combinação de adesivos, é adequado para controlar sua dor. O adesivo deve ser aplicado na pele e mantido por sete dias. Após sete dias, retire o adesivo e aplique um novo adesivo na pele em um lugar diferente.
Utilizando pela primeira vez
- A dose inicial usual de Restiva® é de 5 mg, aplicada uma vez a cada 7 dias. Adesivos de 10 e 20 mg estão disponíveis para dores mais fortes. Seu médico pode prescrever uma combinação de adesivos, se necessário, para controlar sua dor.
- O primeiro adesivo pode levar até três dias para alcançar o efeito máximo. Isso porque a buprenorfina é absorvida lentamente através da pele. Seu médico pode prescrever medicamentos adicionais para controlar a dor durante esse tempo.
Aplicando o adesivo
- Encontre uma região de pele limpa e intacta na parte externa superior do braço, na região superior do tórax, superior das costas ou do lado do tórax. Não aplique o adesivo na pele quando estiver vermelha, queimada ou lesionada. O local da aplicação deve ser alternado se o adesivo for reaplicado ou quando for ser aplicado um segundo adesivo. O local de aplicação pode ser repetido após intervalo de pelo menos 3 semanas.
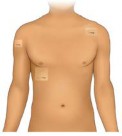
- Certifique-se de que o local esteja quase sem pelos e sem cicatrizes grandes. Se a região apresentar pelos, corte-os com tesoura, mas não depile ou raspe a área escolhida, já que isso pode lesionar a pele.
- A área escolhida deve estar limpa. Se necessário, lave a área somente com água limpa, não use sabão, álcool, óleos, loções ou dispositivos abrasivos. A área escolhida para aplicar o adesivo deve estar seca, portanto, seque a área completamente após a lavagem com água.
- Retire o adesivo do sachê. Restiva® deve ser aplicado imediatamente após a abertura do sachê.
- Para aplicar o adesivo, retire a camada de proteção e pressione firmemente o adesivo com a palma da mão no local escolhido por aproximadamente 30 segundos.
- Certifique-se que todo o adesivo está em contato com a pele especialmente ao redor das bordas. Se as bordas do adesivo começarem a se soltar, elas podem ser grudadas com uma fita adesiva adequada para pele.
- Lave suas mãos com água limpa.
O adesivo deve ser usado continuamente por 7 dias, não é afetado por banho, ducha e natação. Entretanto, é recomendado mantê-lo seco sempre que possível. Se um adesivo cair, um novo deve ser aplicado, seguindo as recomendações acima.
Durante o tratamento com Restiva®, deve-se evitar exposição do local de aplicação a fontes de calor externas, tais como almofadas de aquecimento, cobertores elétricos, lâmpadas de aquecimento, etc, já que pode ocorrer aumento na absorção da buprenorfina, o que pode levar a um aumento na incidência de eventos adversos relacionados aos opioides.
Os efeitos de uso de Restiva® em banheiras quentes e sauna não foram estudados.
Durante o tratamento com Restiva®, também se deve evitar o uso de protetores solares, soluções, cremes e outros produtos na área em que o adesivo será aplicado.
Trocando o adesivo
Troque seu adesivo no mesmo horário do mesmo dia de cada semana. Por exemplo, se você começar a usar seu adesivo às 9h00 da manhã de segunda-feira, troque seu adesivo na próxima segunda-feira às 9h00.
- Após sete dias de uso, retire o adesivo.
- Dobre o adesivo pela metade de modo que o lado adesivo fique para dentro.
- Jogue o adesivo em um lugar seguro, fora do alcance de crianças.
- Aplique um novo adesivo em uma área diferente da pele, seguindo as etapas “Aplicando o adesivo”.
- O local da aplicação deve ser alternado se um adesivo for reaplicado ou adicionado. O local de aplicação pode ser repetido após intervalo de pelo menos 3 semanas.
Posologia
A menor dose de Restiva®, 5 mg, deve ser usada como a dose inicial em todos os pacientes.
No tratamento da dor é fundamental a avaliação do paciente. Além disso, a terapia deverá ser revisada regularmente, sendo ajustada baseando-se nas informações do próprio paciente referentes à dor e reações adversas, bem como na avaliação clínica do médico.
Como ocorre com todos os opioides, a concentração plasmática efetiva mínima para analgesia varia entre os pacientes, especialmente em pacientes tratados anteriormente com opioides agonistas potentes. Consequentemente, os pacientes devem ser tratados com variação individualizada da dose para se obter o efeito desejado. A dose efetiva mínima de buprenorfina poderá aumentar em função do uso de doses repetidas, em qualquer paciente, devido ao aumento da dor e/ou desenvolvimento de tolerância farmacológica.
Idosos
Não é necessário ajuste de dosagem no idoso.
Crianças
Não foi estabelecida a segurança e eficácia de Restiva® em pacientes com menos de 18 anos de idade.
Insuficiência renal
Não é necessário ajuste de dose em pacientes com insuficiência renal.
Insuficiência hepática
Em pacientes com insuficiência hepática leve a moderada, não é necessário ajuste de dose de Restiva® . Pacientes com insuficiência hepática grave podem acumular buprenorfina durante o tratamento. Deve-se considerar terapia alternativa e Restiva® deve ser usado com cautela neste caso.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento do seu médico.
Descontinuação
Após a remoção de um adesivo de Restiva®, as concentrações da substância no sangue diminuem gradativamente. Isto deve ser considerado quando a terapia com Restiva® for seguida por tratamento com outros opioides. Como uma regra geral, um opioide subsequente não deve ser administrado dentro de 24 horas após a remoção de um adesivo Restiva®.
Este medicamento não deve ser cortado.
O QUE DEVO FAZER QUANDO EU ME ESQUECER DE USAR ESTE MEDICAMENTO?
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Se você esquecer de trocar o adesivo
Trocar o adesivo (aplicar um novo) e seguir os intervalos conforme descrito acima, baseando-se no dia e horário que aplicou o novo adesivo.
Não aplique dois adesivos ao mesmo tempo para compensar dose omitida. Isto aumentará a chance de ter reações adversas indesejáveis
QUAIS OS MALES QUE ESTE MEDICAMENTO PODE ME CAUSAR?
Em geral, as reações adversas incluídas neste item são aquelas com uma relação plausível com o uso do medicamento.
As frequências das reações adversas são dadas como se segue:
| Categoria | Frequência |
| Muito comum | ≥ 10% |
| Comum | ≥ 1% e < 10% |
| Incomum | ≥ 0,1% e < 1% |
| Raro | ≥ 0,01% e < 0,1% |
| Muito raro | < 0,01% |
| Desconhecida | Não pode ser estimada pelos dados disponíveis |
Distúrbios do sistema imunológico
- Incomum: reações alérgicas (incluindo inchaço da garganta e da língua)
- Rara: respostas anafiláticas (reação alérgica grave e imediata que pode levar à morte)
Distúrbios metabólico e nutricional
- Comum: anorexia (redução ou perda do apetite) Rara: desidratação
Distúrbios psiquiátricos
- Comum: confusão, depressão, insônia, nervosismo, ansiedade
- Incomum: labilidade de afeto, agitação, humor eufórico, alucinação, diminuição da libido, pesadelos, agressão
- Rara: distúrbio psicótico
- Não conhecida: despersonalização (experiências de sentimentos de irrealidade, de ruptura com a personalidade)
Distúrbios do sistema nervoso
- Muito comum: tontura, dor de cabeça, sonolência Comum: tremor
- Incomum: comprometimento da concentração, coordenação anormal, disartria (dificuldade de articular as palavras), disgeusia (alteração ou diminuição do paladar), hipoestesia (perda ou diminuição de sensibilidade em determinada parte do organismo), comprometimento da memória, enxaqueca, síncope (desmaio), parestesia (sensação anormal como ardor, formigamento e coceira na pele)
- Nao conhecida: convulsões
Distúrbios oculares
- Incomum: olho seco, visão embaçada
- Rara: miose (diminuição do diâmetro da pupila)
Distúrbios do ouvido e labirinto
- Incomum: tinido (zumbido no ouvido) e vertigem (tontura)
Distúrbios cardíacos
- Incomum: palpitações, taquicardia (aceleração do ritmo cardíaco)
- Rara: angina de peito (dor no peito, relacionada à doença das artérias coronárias)
Distúrbios vasculares
- Incomum: vermelhidão, hipertensão (pressão alta), hipotensão (pressão baixa)
- Rara: vasodilatação, hipotensão ortostática (queda súbita de pressão arterial na posição ereta)
Distúrbios respiratório, torácico e mediastinal
- Comum: dispneia (dificuldade respiratória, falta de ar) Incomum: tosse, soluços, chiado no peito
- Rara: insuficiência respiratória, depressão respiratória, asma agravada, hiperventilação, rinite
Distúrbios gastrintestinais
- Muito comum: constipação, náusea, vômito
- Comum: dor abdominal, diarreia, dispepsia (má digestão), boca seca Incomum: flatulência
- Rara: disfagia (dificuldade de engolir), íleo paralítico (obstrução funcional dos intestinos)
- Não conhecida: diverticulite (inflamação no intestino grosso)
Distúrbios hepatobiliares
- Não conhecida: cólica biliar
Distúrbios da pele e tecido subcutâneo
- Muito comum: prurido (coceira e/ou ardência)
- Comum: eritema (vermelhidão), sudorese
- Incomum: pele seca, urticária, dermatite de contato (inflamação na pele)**
- Rara: edema (inchaço) facial
Distúrbios musculoesqueléticos e do tecido conjuntivo
- Incomum: espasmos musculares, mialgia (dor muscular)
Distúrbios renal e urinário
- Incomum: incontinência urinária (perda de urina), retenção urinária (dificuldade para urinar), hesitação urinária (dificuldade de iniciar a micção)
Distúrbios do sistema reprodutivo e mamário
- Rara: disfunção sexual
Distúrbios gerais e condições no local da administração
- Muito comum: reação no local da aplicação*
- Comum: condições de astenia (incluindo fraqueza muscular), edema periférico (inchaço nas extremidades do corpo)
- Incomum: edema (inchaço), pirexia (febre), tremores, síndrome de retirada, dermatite no local da aplicação**, dor no peito
- Rara: sintomas tipo gripe
- Não conhecido: síndrome de retirada neonatal (sintomas de abstinência no recém-nascido por uso materno da medicação)
Laboratoriais
- Incomum: aumento da alanina aminotransferase (uma enzima do fígado), diminuição de peso
Lesões, envenenamento e complicações do processo
- Incomum: lesão acidental (incluindo queda)
* Inclui: eritema (vermelhidão) no local da aplicação, edema (inchaço) no local da aplicação, prurido (coceira) no local da aplicação, erupção no local da aplicação
** Em alguns casos, reações alérgicas locais tardias ocorreram com sinais evidentes de inflamação. Nesses casos, o tratamento com Restiva® deve ser interrompido.
Atenção: este produto é um medicamento que possui nova forma farmacêutica no país e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, informe seu médico ou cirurgião-dentista.
O QUE FAZER SE ALGUÉM USAR UMA QUANTIDADE MAIOR DO QUE A INDICADA DESTE MEDICAMENTO?
Os sintomas de uma superdosagem incluem depressão respiratória, apneia (parada respiratória), sedação, sonolência, náusea, vômito, colapso cardiovascular (insuficiência cardiovascular) e miose (diminuição das pupilas) marcante.
No caso de superdosagem, retire qualquer adesivo em contato com o paciente e descarte adequadamente e procure socorro médico.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
SÓ PODE SER VENDIDO COM RETENÇÃO DA RECEITA
MS - 1.9198.0002
Farm. Resp: Kátia Esteves dos Santos CRF-SP nº 36.165
Fabricado por:
LTS – Lohmann Therapie Systeme A.G. Andernach - Alemanha
Importado por:
MUNDIPHARMA BRASIL PROD. MÉDICOS E FARMACÊUTICOS LTDA.
Rua Verbo Divino, 2001 – 16º andar – Sala A
Chácara Santo Antônio
São Paulo - SP
CNPJ: 15.127.898/0001-30
SAC 0800 038 6040