📃 Bula do Produto
Apresentação:
Tópicos da Bula
Identificação do medicamentoComposiçãoPara quê este medicamento é indicado?Como este medicamento funciona?Quando não devo usar este medicamento?O que devo saber antes de usar este medicamento?Onde, como e por quanto tempo posso guardar este medicamento?Como devo usar este medicamento?O que devo fazer quando eu me esquecer de usar este medicamento?Quais os males que este medicamento pode me causar?O que fazer se alguém usar uma quantidade maior do que a indicada deste medicamento?Dizeres legaisIDENTIFICAÇÃO DO MEDICAMENTO
Toperma
lidocaína 5%
Emplastros
APRESENTAÇÕES
Embalagens contendo 2 ou 6 Envelopes com 5 emplastros em cada.
USO TÓPICO
USO ADULTO
COMPOSIÇÃO
Cada emplastro de 10 cm x 14 cm contém
| lidocaína (50 mg de lidocaína por grama de base adesiva) | 700 mg (5% p/p) |
| excipiente q.s.p. | 1 emplastro |
Excipientes: água purificada, glicerol, sorbitol, ácido poliacrílico, poliacrilato de sódio, carmelose sódica, propilenoglicol, uréia, caulim, ácido tartárico, gelatina, álcool polivinílico, glicinato de alumínio, edetato dissódico, metilparabeno e propilparabeno.
PARA QUÊ ESTE MEDICAMENTO É INDICADO?
Toperma (lidocaína 5%) é indicado para o tratamento da dor neuropática associada à infecção anterior por herpes zoster (neuralgia pós-herpética, NPH) e para o tratamento da dor neuropática localizada (DNL).
COMO ESTE MEDICAMENTO FUNCIONA?
O emplastro medicamentoso de lidocaína 5% tem um modo duplo de ação: o componente farmacológico e o componente de proteção mecânica.
O componente farmacológico corresponde à contribuição da lidocaína. O mecanismo pelo qual a lidocaína exerce sua atividade anestésica local é bem elucidado. O componente bloqueia a geração e a condução dos impulsos nervosos.
Em estudos clínicos, uma redução da intensidade da dor e alívio da dor foram observados 30 minutos após a aplicação de Toperma.
O outro componente do modo de ação consiste na proteção mecânica das áreas sensíveis da pele pelo próprio emplastro, causando um primeiro alívio das queixas durante o primeiro dia de uso do emplastro. No entanto, pode-se levar até de 2 a 4 semanas até que o efeito completo de alívio da dor seja observado.
QUANDO NÃO DEVO USAR ESTE MEDICAMENTO?
No caso de você ter apresentado alguma reação alérgica a lidocaína, ou qualquer outro componente da fórmula.
O emplastro também é contraindicado a pacientes que apresentam reação alérgica conhecida a anestésicos locais do tipo amida (ex.: bupivacaína, etidocaína, mepivacaína e prilocaína).
O emplastro não deve ser aplicado na pele inflamada ou lesionada, como com lesões herpes zoster ativas, dermatites atópicas ou feridas.
O QUE DEVO SABER ANTES DE USAR ESTE MEDICAMENTO?
O emplastro não deve ser aplicado às membranas mucosas. Evite o contato do emplastro com a área dos olhos.
O emplastro contém uma substância que pode causar irritação à pele. Ele também pode causar reações alérgicas (após o uso).
O emplastro deve ser usado com precaução caso você tenha problemas graves no coração e/ou nos rins e/ou no fígado.
Efeitos na habilidade de dirigir ou operar máquinas
Nenhum estudo sobre os efeitos na habilidade de dirigir ou operar máquinas foi realizado. Efeito na habilidade de dirigir ou operar máquinas é improvável porque a absorção sistêmica é mínima.
Gravidez
Se você está grávida ou amamentando, pensa que pode estar grávida ou está planejando engravidar, consulte o seu médico antes de utilizar Toperma.
O risco potencial para humanos é desconhecido. Portanto, Toperma não deve ser usado durante a gravidez a menos que seja claramente necessário.
Categoria B – Não há estudos adequados em mulheres. Em experiência em animais não foram encontrados riscos, mas foram encontrados efeitos colaterais que não foram confirmados nas mulheres, especialmente durante o último trimestre de gravidez.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Lactação
Não há nenhum estudo específico usando o emplastro em mulheres amamentando. Após a administração sistêmica, a lidocaína é liberada no leite humano. Uma vez que o metabolismo da lidocaína acontece de forma relativamente rápida e quase que completamente no fígado, esperam-se apenas níveis muito pequenos de lidocaína no leite humano.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
ONDE, COMO E POR QUANTO TEMPO POSSO GUARDAR ESTE MEDICAMENTO?
Toperma não deve ser colocado sob refrigeração e nem congelado. Manter em temperatura ambiente (15° C - 30° C). Após aberto pela primeira vez, manter o envelope firmemente fechado.
Após abertura do envelope, o emplastro é válido por 14 dias. Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com prazo de validade vencido. Guarde-o em sua embalagem original.
Aspecto físico
O emplastro Toperma apresenta cor branca a amarelo claro, o material adesivo apresenta um leve odor característico.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
COMO DEVO USAR ESTE MEDICAMENTO?
A área dolorida deve ser coberta com o emplastro uma vez por dia por até 12 horas dentro de um período de 24 horas. Apenas o número de emplastros necessários para o tratamento eficaz deve ser usado. Quando necessário, os emplastros podem ser cortados em pedaços menores com tesoura antes da remoção da película protetora. No total, não mais que 3 emplastros devem ser usados ao mesmo tempo.
O emplastro deve ser aplicado à pele intacta, seca e não irritada (por ex., mas não limitado à: após a cicatrização das lesões no caso de neuralgia pós- herpética; após a cicatrização da incisão decorrente de uma cirurgia; ou seja, sempre na pele sem nenhuma lesão).
Cada emplastro deve ser usado por no máximo 12 horas. O intervalo subsequente sem emplastro deve ser de pelo menos 12 horas. O emplastro pode ser aplicado a qualquer momento durante o dia ou à noite.
O emplastro deve ser aplicado à pele imediatamente após sua retirada do envelope e remoção da película protetora da superfície do gel. Pelos presentes na área afetada devem ser removidos com tesoura (e não depilados).
Seu médico irá definir e reavaliar o período adequado de tratamento para você.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
Modo de usar
Colagem do emplastro
Passo 1: Abra o envelope e remova um ou mais emplastros.


- Corte o envelope ao longo da linha pontilhada;
- Caso utilize uma tesoura, seja cuidadoso no corte para não danificar os emplastros;
- Retire da embalagem um ou mais emplastros, dependendo do tamanho da região afetada da pele.
Passo 2: Feche o envelope.
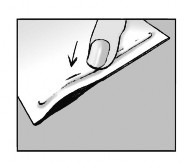
- Feche fortemente o envelope após a utilização;
- Os emplastros contêm água, e se o envelope não for fechado corretamente, podem secar.
Passo 3: Corte o emplastro, se necessário.

- Caso necessário, o emplastro pode ser cortado para adaptar-se ao tamanho adequado da região afetada da pele, antes de remover a película protetora.
Passo 4: Remoção da película protetora.
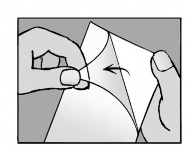
- Remova a película transparente do emplastro;
- Tente não tocar na parte colante do emplastro.
Passo 5: Aplique o emplastro e pressione firmemente contra a pele.
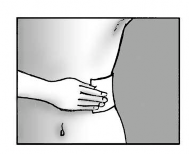
- Aplique até três (3) emplastros na área afetada da pele;
- Pressione o emplastro contra a pele;
- Pressione por pelo menos 10 segundos para assegurar que o emplastro está bem colado;
- Garanta que o emplastro esteja completamente colado à pele, inclusive os cantos.
Deixar o emplastro na pele apenas durante 12 horas.
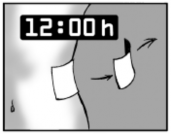
Contato com a água
Se possível, o contato com a água deve ser evitado durante a utilização de Toperma. Tomar banho ou nadar podem ser realizados durante o período em que você não estiver utilizando o emplastro. Caso você tenha acabado de tomar banho ou nadar, deve esperar que o corpo esfrie e seque para então aplicar o emplastro.
Caso o emplastro se solte
Muito raramente o emplastro pode se soltar, descolar ou cair. Caso isto ocorra, você deve tentar recolar na mesma área. Caso não seja possível, remova-o e cole um novo emplastro na mesma área.
Como remover Toperma
Para substituição, remover o emplastro da pele vagarosamente. Caso não se descole com facilidade, pode-se molhar com água morna durante alguns minutos antes de removê-lo.
Caso você tenha se esquecido de remover o emplastro após 12 horas de utilização.
Assim que se lembrar, você deve remover o emplastro. Um novo emplastro somente deve ser aplicado após 12 horas.
Caso você utilize mais emplastros do que deveria
Caso você utilize mais emplastros do que deveria, ou utilize-os durante muito tempo, pode-se aumentar o risco de reações adversas.
O QUE DEVO FAZER QUANDO EU ME ESQUECER DE USAR ESTE MEDICAMENTO?
Caso tenha passado o período de 12 horas em que se deve ficar sem emplastro e você tenha se esquecido de aplicar um novo emplastro, aplique-o assim que se lembrar.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
QUAIS OS MALES QUE ESTE MEDICAMENTO PODE ME CAUSAR?
Em aproximadamente 16% dos pacientes pode-se esperar que ocorram reações adversas. Estas reações são localizadas em decorrência da natureza do medicamento.
Se ocorrer irritação ou sensação de queimação enquanto você estiver usando o emplastro, você deve removê-lo. A área irritada deve ser permanecer sem emplastro até que a irritação passe.
As reações adversas mais comumente notificadas foram: reações no local de administração incluindo eritema, erupção cutânea, coceira no local da aplicação, queimação, dermatites, eritema ou vesícula no local da aplicação, dermatites, irritação na pele e prurido.
Todas as reações adversas foram predominantemente de leve a moderada intensidade. Destas, menos de 5% levaram à descontinuação do tratamento.
Reação muito comum (≥ 1/10): reações no local da administração, que podem incluir vermelhidão, erupção cutânea, coceira, queimação, dermatite e pequenas bolhas.
Reação incomum (> 1/1.000 ≤1/100): lesões na pele, ferimentos na pele.
Reação Muito rara (≤ 1/10.000): reação anafilática, hipersensibilidade (alergia), feridas abertas.
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento. Informe também à empresa através do seu serviço de atendimento.
O QUE FAZER SE ALGUÉM USAR UMA QUANTIDADE MAIOR DO QUE A INDICADA DESTE MEDICAMENTO?
Superdose com emplastro é incomum, mas o uso inapropriado, tais como o uso de um maior número de emplastros ao mesmo tempo, com um período prolongado de aplicação, ou uso na pele ferida, pode resultar em uma alta concentração plasmática.
Alguns sinais e sintomas devem ser observados no caso do uso de uma grande quantidade: tonturas, vômitos, sonolência, convulsões, dilatação da pupila, alteração nas batidas do coração (mais lentas ou fora de ritmo) e choque.
No caso de uma suspeita de superdose o emplastro deve ser removido e medidas de suporte devem ser tomadas. Não há antídoto para lidocaína.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
MS – 1.8610.0002
Farmacêutico responsável: Marcelo Mesquita – CRF-SP nº 31.885
Fabricado por:
Teikoku Seiyaku Co., Ltd
567 Sanbonmatsu, Higashikagawa, Kagawa – Japão
Embalado por: Grünenthal GmbH
Zieglerstraße 6 - Aachen - Alemanha
Importado por:
Grünenthal do Brasil Farmacêutica Ltda.
Avenida Guido Caloi, 1935, Bl. B e Bl. C – 1º andar – São Paulo - SP
CNPJ: 10.555.143/0001-13
SAC: 0800 205 2050